
武大病毒学最新研究:首次揭示蝙蝠MERS相关冠状病毒受体


独家抢先看
原标题:武大病毒学最新研究:首次揭示蝙蝠MERS相关冠状病毒受体
2022年12月7日,国际学术期刊《自然》(Nature)以长文 (Article) 形式在线发表了武汉大学病毒学国家重点实验室/生命科学学院严欢研究组在病毒受体领域的研究成果,论文标题为《MERS冠状病毒在蝙蝠中的近亲病毒使用ACE2作为它们的功能性受体》(Close relatives of MERS-CoV in bats use ACE2 as their functional receptors)。
澎湃新闻发现,该论文的预印本于2022年1月25日上传到预印本网站bioRxiv上。
据武汉大学病毒学国家重点实验室微信公众号消息,该研究成果有助于进一步促进针对使用ACE2受体的MERS相关冠状病毒的基础研究,并为相关疫苗与抗病毒药物的研发奠定基础。“该研究涉及的所有感染实验均使用低风险的假病毒,并未涉及冠状病毒真病毒以及对真病毒进行遗传改造。”
上述消息称,该研究揭示了两种蝙蝠MERS相关冠状病毒(NeoCoV和PDF-2180)的功能性受体为ACE2,解析了这两种病毒与受体结合的复合体以及PDF-2180刺突蛋白三聚体的结构,提示了这一类病毒对人类健康的潜在威胁,并为MERS-CoV的蝙蝠起源假说提供了新的支持证据。
武汉大学病毒学国家重点实验室官网介绍称,该实验室于2004年11月经国家科技部批准立项,2005年3月由国家科技部批准建设。实验室主管部门为国家教育部,依托单位为武汉大学和中国科学院武汉病毒研究所。
该实验室目前拥有中国典型培养物保藏中心(世界知识产权组织认定的国际保藏机构之一)、中国病毒资源与信息中心(亚洲最大的病毒保藏库);建有完善的生物安全实验室(包括二级生物安全实验室BSL-2、三级生物安全实验室BSL-3、动物生物安全三级实验室ABSL-3)。

武汉大学病毒学国家重点实验室/生命科学学院严欢研究员
严欢研究员长期从事病毒受体与病毒入侵机制研究,在Nature, Nature Ecol Evol, eLife, mBio, J Virol等重要学术期刊发表第一或通讯作者论文12篇,曾获2013年吴瑞奖。2008至2016年在北京生命科学研究所李文辉教授实验室攻读博士学位及开展博士后研究期间,在李文辉教授的指导下鉴定了乙肝病毒受体NTCP,解决了困扰领域数十年的科学难题(李文辉教授因该成果获2020年Baruch Blumberg奖和2022年未来科学大奖);2016至2019年在南加州大学医学院博士后工作期间鉴定了人乳头瘤病毒HPV的受体结合多肽;2019年11月加入武汉大学病毒学国家重点实验室/生命科学学院,重点关注人类及蝙蝠冠状病毒、乙肝病毒、人乳头瘤病毒的受体与入侵机制,在冠状病毒受体领域取得了系列重要成果,成功鉴定类MERS蝙蝠冠状病毒NeoCoV和PDF-2180的受体ACE2(Nature,2022)。

2022年12月7日,国际学术期刊《自然》在线发表的论文。
上述消息称,NeoCoV于2012年在南非的开普棕蝠(Cape serotine)样本中被发现,是目前自然界已发现的最接近中东呼吸综合征病毒(MERS-CoV)的一种冠状病毒。严欢研究组在探索多种代表性蝙蝠冠状病毒功能性受体的过程中,发现NeoCoV和PDF-2180这两种MERS相关冠状病毒的假病毒能够以较低效率进入外源表达人ACE2受体的细胞。而领域内的人已经熟知,ACE2(angiotensin-converting enzyme 2)是新冠病毒SARS-CoV-2等Sarbecovirus亚属冠状病毒的受体。这一出乎预料的结果引起了研究组的高度重视。研究人员利用假病毒系统,进一步测试了46种蝙蝠ACE2受体,发现这两种病毒可以更加高效地结合多种阳翼手目蝙蝠的ACE2受体进入细胞。这一结果突破了目前人们对冠状病毒受体的传统认知,首次揭示了MERS相关冠状病毒可以使用ACE2而非DPP4(dipeptidyl peptidase 4,MERS-CoV等Merbecovirus亚属冠状病毒的受体)进入细胞。
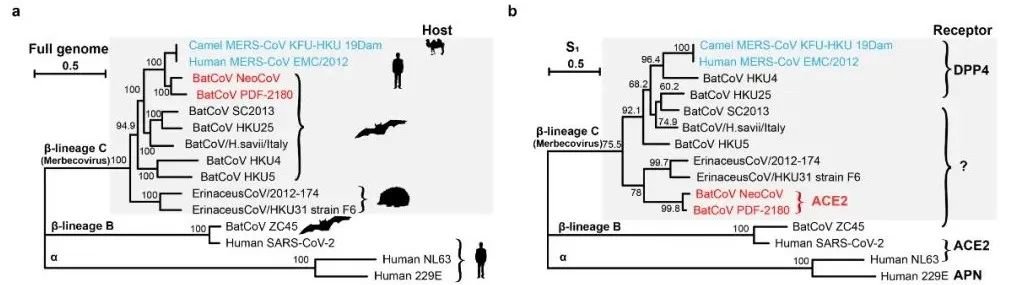
部分代表性冠状病毒的亲缘关系、自然宿主以及受体使用情况。
上述消息称,在此基础上,中科院生物物理所王祥喜团队通过冷冻电镜技术成功解析了伏翼蝠(Pipistrellus pipistrellus)ACE2与这两种病毒刺突蛋白受体结合结构域(RBD)复合物的高分辨率结构,美国华盛顿大学David Veesler团队也通过冷冻电镜技术解析了PDF-2180刺突蛋白全长三聚体的高分辨率结构。结构分析显示,有别于SARS-CoV、SARS-CoV-2和NL63三种同样使用ACE2受体的人类冠状病毒,NeoCoV和PDF-2180使用一种依赖于蛋白-糖基相互作用的全新结合模式识别ACE2。此外,NeoCoV和PDF-2180的RBD在ACE2上的结合印迹(footprint)相对于其它三种病毒也显著不同,这提示在进化历程中,亲缘关系较远的冠状病毒曾趋同进化独立地选择并适应ACE2为受体。
上述消息称,之后,研究人员进一步合作探索了这两种病毒识别受体的分子机制及相关抗体阻断假病毒进入细胞的能力。序列分析与突变研究发现,人ACE2的RBD结合印迹上338-342位氨基酸相对于伏翼蝠ACE2的序列差异是导致其介导感染能力较差的关键原因,但NeoCoV可通过其刺突蛋白上T510F的单点突变实现对人ACE2的高效识别。抗体中和实验显示,新冠疫苗接种者的血清和靶向MERS-CoV RBD的单克隆抗体在目前的实验条件下均无法抑制NeoCoV和PDF-2180假病毒的感染,而靶向ACE2的特异性抗体(H11B11)以及两种针对β属冠状病毒的广谱中和抗体(B6和S2P6)可以有效地阻断这两种病毒的假病毒进入细胞。
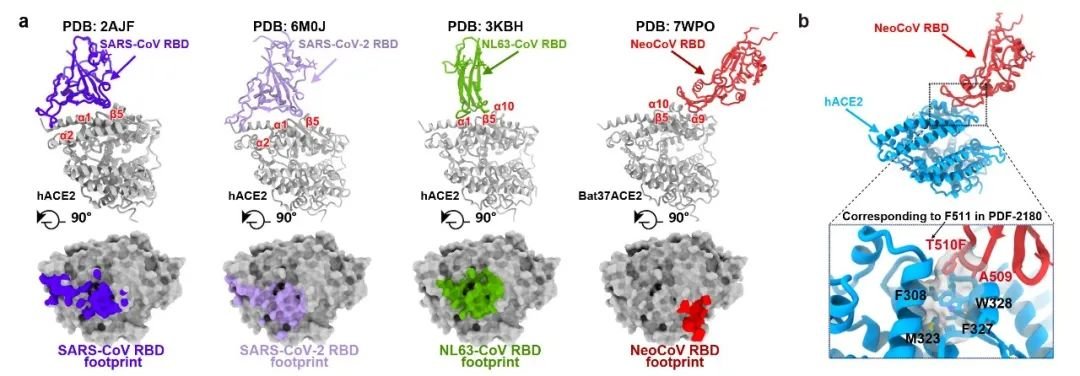
不同冠状病毒RBD及其结合ACE2的模式 (a) 和携带T510F突变的NeoCoV RBD与人ACE2的相互作用(b)。
武汉大学病毒学国家重点实验室/生命科学学院、泰康生命医学中心严欢研究员,中科院生物物理所王祥喜研究员和美国华盛顿大学生物化学系David Veesler教授为该论文的共同通讯作者;武汉大学生命科学学院博士生熊清、硕士研究生马成鲍、中科院生物物理所曹磊副研究员和美国华盛顿大学生物化学系M. Alejandra Tortorici博士为该论文的共同第一作者。该研究得到国家自然科学基金、武汉大学新冠肺炎研究专项基金、中国科学院战略重点研究项目、国家重点研发计划项目等资助。

严欢研究组合照。
论文链接:https://www.nature.com/articles/s41586-022-05513-3
武汉大学病毒学国家重点实验室微信公众号发布的相关研究背景:
本世纪以来,三种β属冠状病毒(SARS-CoV, MERS-CoV,SARS-CoV-2)在人群中引发了三次重大疫情:即非典(SARS)、中东呼吸综合征(MERS)、以及新冠(COVID-19)。实际上,这三种病毒只是冠状病毒大家族的冰山一角,而人类对自然界许多有潜在人畜共患风险的冠状病毒的了解还非常有限。冠状病毒通过识别细胞表面的受体分子进入宿主细胞,故受体在很大程度上决定了病毒的宿主范围,组织嗜性与传播能力。因此,成功鉴定冠状病毒受体并建立相应感染模型对揭示病毒感染与传播规律、评价病毒致病力与宿主免疫反应,以及开发疫苗与抗病毒药物具有重要意义。目前领域内普遍认为,Sarbecovirus亚属冠状病毒(如SARS-CoV和SARS-CoV-2)主要以ACE2为受体,Merbecovirus亚属冠状病毒(如MERS-CoV)主要以DPP4为受体,但仍有很多β属冠状病毒的受体尚不明确。
MERS-CoV是目前已知致病力最强的人类冠状病毒,最早于2012年在沙特阿拉伯被发现,主要在中东地区国家流行。世界卫生组织(WHO)的最新统计数据显示,MERS已造成2600人的感染,其中935人死亡,病死率高达36%,所幸MERS-CoV传播能力明显弱于新冠病毒(SARS-CoV-2),在2016年之后只在中东地区有零星感染。MERS-CoV的中间宿主是骆驼,但其自然进化起源尚不明确。但越来越多的证据表明,蝙蝠作为数百种ɑ和β属冠状病毒的天然宿主,在包括MERS-CoV在内多种人类冠状病毒的进化过程中扮演了重要角色。NeoCoV与PDF-2180分别于2012年与2017年在南非与乌干达的蝙蝠样本中被发现,是自然界目前已知最接近MERS-CoV的两种冠状病毒,进化上与MERS-CoV属于同一个病毒物种。但由于受体不明确,相关的研究报道寥寥无几。严欢研究员领衔的这项研究利用基于水泡性口炎(VSV)的假病毒系统结合结构分析等技术手段,揭示了MERS-CoV在蝙蝠中的近亲病毒NeoCoV与PDF-2180使用ACE2为受体。鉴于尚未有报道发现蝙蝠MERS相关病毒(特指该病毒物种,非Merbecovirus亚属成员)使用DPP4为受体,MERS-CoV在蝙蝠中的祖先可能与NeoCoV一样使用ACE2为受体,但后来通过与其它使用DPP4为受体的冠状病毒(如与MERS-CoV同属于Merbecovirus亚属,但属于不同病毒物种的HKU4)重组进化成为MERS-CoV。需要强调的是,目前使用ACE2的MERS相关冠状病毒是否可以感染人类并引发疫情并不清楚,其致病力与传播能力也有待进一步研究。人类无法清除自然界的冠状病毒,也难以完全避开与这些病毒的接触,只有通过研究找出对人类有威胁的冠状病毒,加强对这些病毒的监测预警与基础研究,未雨绸缪,才能使人类在与病毒的博弈中立于不败之地。
(注:图片及素材来源于网络,版权归原作者所有。如有侵权请联系删除,电话:027-85721622 。)






